Cuando se habla de las células que conforman al sistema nervioso central, todos pensamos en las neuronas, asombrosas unidades de señalización que reciben, integran y transmiten información de manera química o eléctrica. Sin embargo, las neuronas no podrían sostener por sí solas toda la fascinante maquinaria que es el cerebro. Necesitan apoyo para nutrirse, migrar e integrarse a su circuito cuando aún son células jóvenes. Además, requieren ser protegidas del daño físico o infeccioso, y para esto, están las células microgliales. Esta población celular, ayuda a las neuronas a sobrevivir, a generar sinapsis y las mantiene libres de agentes potencialmente tóxicos para ellas. No obstante, cuando las condiciones no son las adecuadas, son capaces de eliminarlas, favoreciendo la aparición de enfermedades y disfunciones motoras y cognitivas a lo largo de la vida de los individuos.
Palabras clave: Macrófagos cerebrales, neurodegeneración, neuroinflamación, neuroplasticidad.
Jonathan Josué Zamudio-Flores Cerca del 90 % del tejido neuronal está compuesto por células gliales, las cuales mantienen en unidad al cerebro, de ahí su nombre, proveniente del griego «glía» (γλíα) que significa ‘unión’ o ‘pegamento’. La glía o neuroglia se divide en dos grupos, dependiendo de su origen: la glía de linaje ectodérmico, que comprende los astrocitos y los oligodendrocitos; la glía derivada de la médula ósea denominada microglía. Los oligodendrocitos son las células que envuelven los axones de las neuronas para formar las vainas de mielina, esas capas protectoras que facilitan la conducción de las señales eléctricas a través de la neurona. Los astrocitos, por su parte, son la población de neuroglia más abundante, tienen forma de estrella (de ahí su nombre) y se dividen en dos clases según su forma y localización. Los astrocitos funcionan como un sistema de «rieles» para las neuronas que les ayudan a encontrar otras con las cuales formar sinapsis y mantener su estructura. Además, están en asociación con una red de vasos sanguíneos que, en conjunto, forman la llamada «barrera hematoencefálica». La función de esta barrera es impedir la entrada al cerebro de sustancias tóxicas y de células inmunitarias. El cerebro es un órgano muy sensible a las variaciones de su microambiente, por lo que esta barrera le da un carácter de «inmunoprivilegio». Pero, ¿qué pasa cuando hay un daño en el cerebro y la barrera hematoencefálica no permite que las células del sistema inmunológico ingresen y lo reparen? Aquí entra en acción la última población de neuroglia: la microglía. Entre los fenotipos de la microglía, existe aquel que funciona como apoyo en la generación de nuevas neuronas. Estudios sugieren que esto está mediado por la producción de citocinas como las interleucinas 6 y 1 beta o el interferón gama. Otro fenotipo microglial produce factores neurotróficos, es decir, proteínas que promueven la supervivencia de las neuronas y evitan el daño celular, como el factor de crecimiento nervioso, el factor neurotrófico derivado del cerebro y el factor neurotrófico tipo-insulina 1. Existe otro proceso neuroplástico importante en el desarrollo temprano del cerebro llamado «poda sináptica», el cual consiste en la eliminación de sinapsis no-funcionales e innecesarias, con el fin de volver más eficiente la conectividad entre las neuronas; se sabe que existen fenotipos microgliales que se encargan de esto. Las acciones inmunológicas de la microglía son las más variables y dependen del tipo de daño que detecten y del tiempo a partir del cual se generó. A corto plazo, existe una respuesta inmune innata, en donde reconoce señales que indican un daño en el tejido (llamadas DAMPs), o la presencia de bacterias, virus u otro agente patógeno (PAMPs). La respuesta que tiene la microglía ante estos mensajeros es la producción de citocinas proinflamatorias que promueve tanto la reparación del tejido sano como la eliminación de los patógenos de las neuronas dañadas o infectadas (fagocitosis). La respuesta adaptativa, por su parte, se da cuando las células ya están preparadas para detectar esas señales en un segundo encuentro, por lo que actúan de forma más eficiente. Si la microglía tiene la capacidad de eliminar neuronas, ¿es esto siempre en pro del estado de equilibrio del cuerpo?, ¿tener una respuesta tan rápida y eficiente siempre es benéfico? Cuando existe una lesión cerebral, la microglía es la primera línea de defensa. En este tipo de daño, es común que existan rupturas de la barrera hematoencefálica, entonces, la microglía monta la respuesta inflamatoria con el fin de reclutar células limpiadoras de afuera hacia la zona del daño. En un caso ideal, cuando los macrófagos terminan de eliminar las neuronas dañadas, la microglía restaura las conexiones y apaga la respuesta mediante la producción de citocinas antiinflamatorias, volviendo al sistema a un estado de equilibrio (respuesta aguda). Sin embargo, existe otra realidad: al estar en comunicación con los macrófagos reclutados, con los astrocitos activados y con las neuronas dañadas, más células microgliales adoptarán el fenotipo proinflamatorio en un afán de limpiar el área afectada. Si este conflicto no se resuelve, se convertirá en una inflamación crónica que llevará a un deterioro cerebral. Es decir, una muerte neuronal en efecto dominó. Existen otros fenómenos que contribuyen a la inflamación crónica e impiden su resolución. Recordemos que las neuronas se pueden estimular y comunicar mediante mensajeros químicos. Cuando una neurona muere, libera estos mensajeros al espacio externo, los cuales son detectados por las neuronas cercanas. En el caso de una lesión cerebral, la cantidad de mensajeros químicos liberados será tal que las neuronas que rodean la zona del daño recibirán una sobreestimulación hasta la muerte. A este fenómeno se le conoce como «excitotoxicidad» y es un evento que también intensifica la respuesta proinflamatoria de la microglía. Algo similar ocurre en la enfermedad de Alzheimer. Aquí, el principal tipo de daño se le atribuye a la acumulación de una proteína mal plegada o anormal llamada amiloide β1-40/42, la cual, agregada en forma de placa, es tóxica para las neuronas. Cuando la microglía detecta la acumulación de placa amiloide, se aglomera sobre ella para tratar de removerla. En esta reacción, no suele haber una fagocitosis exitosa, pero sí una liberación excesiva de sustancias tóxicas para las células que, más que eliminar al enemigo, mata a las neuronas sanas que lo rodean. Estas acciones de doble filo se deben a que la microglía no suele tener una sola función, pro o antiinflamatoria, sino que puede adoptar características de ambos. En conjunto, la respuesta tirará hacia un lado u otro de la balanza. Existen muchos estudios que buscan promover la activación de fenotipos de reparación y evitar los de destrucción. Uno de ellos es el uso de microRNAs para modular la expresión de citocinas y quimiocinas. También, se ha sugerido el uso de células madre, así como intervenciones conductuales, como el ejercicio físico y cognitivo. Otro potencial blanco terapéutico es la comunidad de bacterias que habitan en el intestino de forma natural, llamada microbiota. Se sabe que la microbiota está en constante comunicación con el cerebro por medio del sistema inmunológico periférico y que, incluso, puede regular muchas de sus funciones. Entonces, una intervención en la composición de la microbiota intestinal podría regular la respuesta inflamatoria periférica y, a su vez, esta modularía la actividad microglial. En todos los casos, existen limitaciones y se requieren muchos estudios para proponer terapias efectivas ante las enfermedades neurodegenerativas. La acción de la microglía y, en general, del sistema neuroinmunológico, no es blanco o negro. Existen matices debido a que la naturaleza siempre opta por la eficiencia del sistema. Aún se desconocen los procesos fisiológicos que conectan al sistema nervioso, el sistema inmunológico periférico, el sistema digestivo y el sistema endocrino. El estudio de estas interconexiones podría traer a la luz una gran cantidad de mecanismos compensatorios que podríamos utilizar como potenciales estrategias terapéuticas a favor del funcionamiento del sistema nervioso central.
Harry G.J. y McPherson C.A. (2010). Microglia: Neuroprotective and Neurodestructive Properties. In: Harry, G. J., Tilson, H. A. Neurotoxicology (3rd ed.). CRC Press. https://doi.org/10.3109/9781420054880 Martínez-Tapia R.J., Estrada-Rojo F., Hernández-Chávez A.A., Barajas-Martínez A., Islas-Escoto S., Navarro L. y Chavarría A. (2018). Neuroinflamación: el ying-yang de la neuroinmunología. Revista de la Facultad de Medicina, 61(5), 44-53. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0026-17422018000500044&lng=es&tlng=es Saavedra-Torres J.S., Guayambuco-Medina M.A., Salazar M.R., Álvarez-Camargo J.C., Medina-Ortega M.A., Salguero C. y Clavijo C.A. (2024). La compleja y heterogénea evidencia que describe la biología celular en la neuroinflamación. Interdisciplinary Journal of Epidemiology and Public Health, 7(2), e-10605. https://doi.org/10.18041/2665-427X/ijeph.2.10605.
Resumen

Estudiante del Programa de Maestría en Ciencias en Ecología Integrativa del
Instituto de Investigaciones sobre los Recursos Naturales (INIRENA-UMSNH).
Centro de Investigación Biomédica de Michoacán (CIBIMI-IMSS).
Morelia, México.
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.¿Qué es y qué hace la neuroglia?
Los distintos fenotipos microgliales
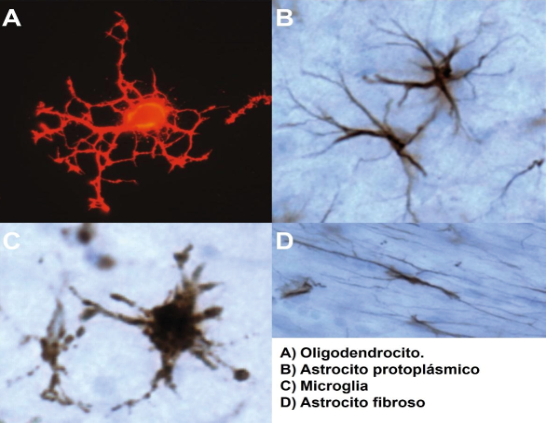 La microglía tiene el mismo linaje que el tipo de células limpiadoras pertenecientes al sistema inmunitario periférico llamado «macrófagos». Es por esto que la microglía se comunica mediante mensajeros químicos similares. Entre estos mensajeros se encuentran las citocinas, las quimiocinas y otras sustancias que promueven la inflamación y la muerte o la supervivencia celular. Con este armamento, las células microgliales se consideran como el sistema inmunológico del cerebro. El ejército local que se encuentra continuamente escaneando su entorno y recibiendo información de las neuronas y los guardias de la barrera hematoencefálica son los astrocitos. Dependiendo del tipo de cambios que la microglía detecte en su ambiente, adoptará distintos fenotipos, es decir, tendrá una morfología y función diferentes.
La microglía tiene el mismo linaje que el tipo de células limpiadoras pertenecientes al sistema inmunitario periférico llamado «macrófagos». Es por esto que la microglía se comunica mediante mensajeros químicos similares. Entre estos mensajeros se encuentran las citocinas, las quimiocinas y otras sustancias que promueven la inflamación y la muerte o la supervivencia celular. Con este armamento, las células microgliales se consideran como el sistema inmunológico del cerebro. El ejército local que se encuentra continuamente escaneando su entorno y recibiendo información de las neuronas y los guardias de la barrera hematoencefálica son los astrocitos. Dependiendo del tipo de cambios que la microglía detecte en su ambiente, adoptará distintos fenotipos, es decir, tendrá una morfología y función diferentes.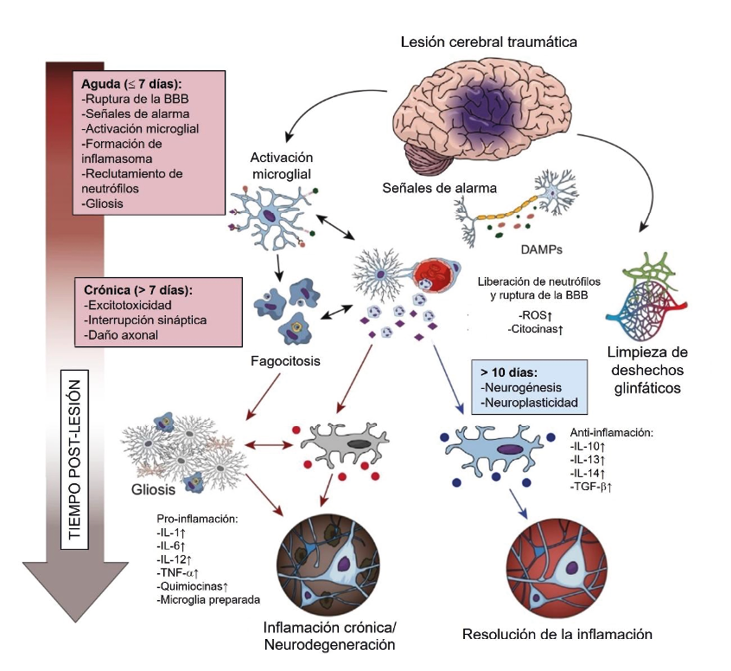
La doble cara de la microglía
¿Se puede evitar el lado oscuro de la microglía?
Potencial en estrategias terapéuticas


