La mitocondria es el principal orgánulo celular productor de energía de los eucariontes. La molécula de adenosina trifosfato, más conocida como ATP, es la “moneda de cambio” de la célula; sin embargo, el conseguirla requiere de un trabajo coordinado, exhaustivo y muy complejo.
La mitocondria es como una “empresa” que ofrece diversos servicios a la célula, para ello es requerida una gran diversidad de departamentos bien organizados: seguridad (sistemas antioxidantes), capacitación (ribosomas y chaperonas moleculares), exportación e importación (canales de membrana), inversionistas (moléculas donadoras de electrones), obreros (proteínas de la cadena de transporte de electrones), maquinaria (ATP sintasa), maquiladoras (síntesis de cofactores), etc. Todos estos “departamentos” trabajan en conjunto para lograr hacer de la mitocondria una empresa sustentable.
Los procesos protagonistas
La mitocondria es un orgánulo con dos membranas (externa e interna) que rodean una matriz. Tiene como característica dos procesos protagonistas principales que son: la síntesis de herramientas en la matriz y la cadena transportadora de electrones de la membrana interna, esta última, la concebiremos como los obreros, pues representan a «las proteínas que generarán la fuerza de trabajo que requieren las turbinas de la fábrica generadora de las moléculas de energía, el codiciado ATP».
Parte del gran éxito empresarial radica en que la mitocondria misma es, por una parte, productora de algunas de sus herramientas de trabajo, y por otro lado, coordina el trabajo entre sus obreros. En este sentido, empezaremos describiendo cómo se producen las herramientas que son usadas por éstos para producir el “oro químico” (ATP), en esta empresa celular llamada mitocondria.
Síntesis de herramientas de trabajo
Los cofactores son moléculas de baja masa molecular que se unen a sitios específicos de proteínas (obreros), y para que éstas realicen su función, existen cofactores de naturaleza orgánica e inorgánica. La síntesis de cofactores son procesos muy conservados y complejos entre los organismos. Los principales cofactores o herramientas de la cadena de transporte de electrones son iones de cobre, flavinas, grupos hemo y centros Hierro-Azufre [Fe-S].
Todo obrero requiere de herramientas para realizar su trabajo, y como se mencionó anteriormente, algunas son sintetizadas en la misma mitocondria. La construcción de centros [Fe-S], la lleva a cabo principalmente una compleja maquinaria biosintética mitocondrial, nombrada ISC por sus siglas en inglés (Iron Sulfur Cluster). Las levaduras son el mejor modelo biológico para el estudio de esta vía; se han descrito alrededor de 18 proteínas que trabajan dentro de la mitocondria encargadas de sintetizar los centros [Fe-S] de diferentes configuraciones: centros [2Fe-2S], es decir, dos átomos de hierro unidos a dos átomos de azufre formando un rombo; centros [4Fe-4S], aquellos de cuatro átomos de hierro y cuatro átomos de azufre formando una estructura cúbica, y algunos otros más complejos. El proceso de síntesis comprende dos pasos principales: el ensamblaje del cofactor en proteínas transitorias, y la transferencia de éstos hasta los sitios donde serán usados por otras proteínas.
Otro grupo de herramientas que se sintetizan en la mitocondria son los grupos hemo, a diferencia de los centros [Fe-S], descritos anteriormente, estos cofactores requieren de mano de obra interna y externa, es decir, los precursores de los grupos hemo son enviados al “país vecino” (el citosol) para ser procesados químicamente, los cuales nuevamente se transportarán hacia la mitocondria para completar la síntesis y emplearse como nuevas herramientas.
La empresa que sostiene la vida de la célula
En esta imagen se resaltan las mitocondrias como industrias que producen energía para las demandas energéticas de la célula.
Exportación, importación y selección de personal
Esta empresa cuenta con tratados de comercio de importación y exportación mediante varios sistemas aduanales que comunican al citosol con la matriz mitocondrial. La mayoría de transportadores mitocondriales no se han identificado, aunque es lógico que se requieren de transportadores de aminoácidos para la construcción de proteínas mitocondriales, transportadores de hierro para la síntesis de cofactores, transportadores de nucleótidos para la síntesis de ácidos nucleicos, y muy importante mencionar, los transportadores de proteínas provenientes del núcleo.
Estos transportadores los podemos encontrar principalmente en la membrana interna mitocondrial, la cual hace las veces de “puentes fronterizos”, ya que, no permite el paso de la mayoría de las moléculas. Estos sistemas hacen de la mitocondria una empresa altamente selectiva de materiales de calidad para la producción, así como de personal calificado y especializado.
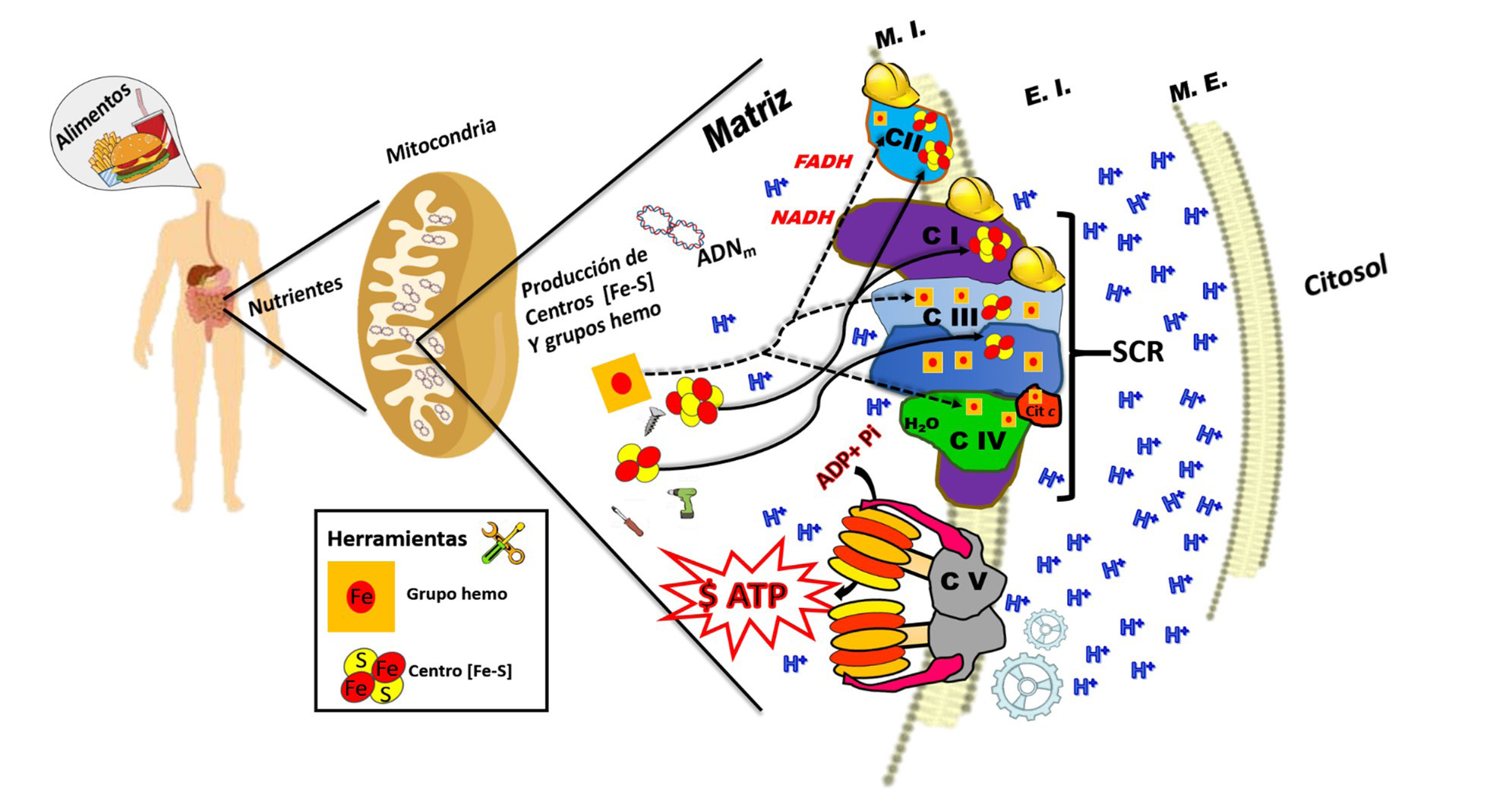 Los alimentos son ingeridos y degradados por el sistema digestivo, los nutrientes son metabolizados hasta obtener ATP principalmente por la fosforilación oxidativa mitocondrial. La imagen representa la organización de la mitocondria, M.I. membrana interna; E.I. espacio intermembranas; M.E. membrana externa; SCR supercomplejos respiratorios, Complejo I, Complejo II, Complejo III y Complejo IV. Se muestran los donadores de electrones NADH y FADH; los cofactores [Fe-S] y grupos hemo, herramientas que utilizan los obreros (SCR) para generar un gradiente electroquímico que se aprovechará en la producción de ATP por la ATP-sintasa (CV).
Los alimentos son ingeridos y degradados por el sistema digestivo, los nutrientes son metabolizados hasta obtener ATP principalmente por la fosforilación oxidativa mitocondrial. La imagen representa la organización de la mitocondria, M.I. membrana interna; E.I. espacio intermembranas; M.E. membrana externa; SCR supercomplejos respiratorios, Complejo I, Complejo II, Complejo III y Complejo IV. Se muestran los donadores de electrones NADH y FADH; los cofactores [Fe-S] y grupos hemo, herramientas que utilizan los obreros (SCR) para generar un gradiente electroquímico que se aprovechará en la producción de ATP por la ATP-sintasa (CV).
Producción de ATP
La transformación de los alimentos que consumimos en ATP, se lleva a cabo principalmente por la fosforilación oxidativa ocurrida en la mitocondria. Durante la respiración celular, los electrones son “recolectados” de la degradación de azúcares, proteínas y lípidos por ciertas coenzimas que sirven como camiones de carga (NAD y FAD); después, los electrones son entregados a los obreros de la membrana interna mitocondrial para que realicen su trabajo. Los obreros destinados a la producción de energía contratados por la mitocondria, forman cinco equipos denominados complejos respiratorios: complejo I, II, III, IV, y un complejo V (CV). Capacitados con sus respectivas herramientas, estos equipos forman asociaciones nombradas “supercomplejos mitocondriales”, lo que hace más eficiente el trabajo en grupo. Cada complejo tiene funciones y formas de trabajo diferentes; sin embargo, actúan ordenadamente para llevar acabo sus propósitos: la transferencia de electrones y la translocación de protones de la matriz mitocondrial al espacio intermembranal.
El flujo de electrones va de un bajo potencial de reducción a un mayor potencial, y se logra gracias a los diferentes potenciales de reducción de los cofactores que utilizan los complejos respiratorios. La energía empleada en la transferencia de electrones, genera fuerza de trabajo para transferir protones al espacio entre membranas mitocondriales, lo que dará lugar a la formación de un gradiente eléctrico que será aprovechado por el complejo V para sintetizar el ATP.
El complejo V o ATP-sintasa, es el último eslabón industrial de producción de ATP, este complejo cuenta con dos módulos operacionales: el módulo F0, el cual se ancla a la membrana y sirve como turbina, y cuyo combustible es la energía almacenada en el gradiente electroquímico de protones; el segundo módulo es el F1, que se orienta a la matriz mitocondrial. Estos módulos están conectados por un brazo lateral inmóvil, además de un rotor central que gira conforme pasan los protones en la turbina; este trabajo impulsa cambios conformacionales dentro del módulo F1 para la síntesis de ATP a partir de la materia prima (ADP y fosfato). Se estima que se producen aproximadamente 100 moléculas de ATP por segundo por cada ATP-sintasa. Esta organización es responsable de proveer el ATP para la “manutención” celular.

La imagen representa el fallo de la mitocondria, al romperse las membranas mitocondriales se disipa el gradiente electroquímico, los obreros son despedidos por lo que la producción se viene abajo provocando la muerte celular.
Cuando la mitocondria falla
Diversas anomalías pueden causar una disfunción en la producción de ATP mitocondrial: fallas en la síntesis de cofactores, daño a proteínas de la CTE y daño a la ATP-sintasa son las principales causas. No obstante, más de 150 síndromes han sido asociados a fallas en la mitocondria. Los casos clínicos incluyen encefalopatías, miopatías, cardiomiopatías, diabetes y enfermedades renales; muchos de los casos se relacionan con el daño al ADN mitocondrial, debido a la sobreproducción de especies reactivas de oxígeno (ERO) por la CTE. La mitocondria soporta cierto umbral de ERO; sin embargo, cuando los sistemas antioxidantes son rebasados, las moléculas de ADN mitocondrial son las de mayor susceptibilidad a los radicales libres, provocando una alta tasa de mutaciones que en consecuencia afectan la síntesis de las proteínas que se requieren dentro de la mitocondria.
Un desequilibrio por la pérdida o malformación de cofactores como los grupos hemo y los centros [Fe-S] de sus respectivas proteínas, causa una sobre carga de hierro mitocondrial, lo que desencadena una excesiva producción de radicales libres mediante “círculos viciosos” entre iones metálicos y ERO. El daño puede ser tan grande que la mitocondria puede declararse en quiebra y venirse abajo, desencadenando la muerte celular.
El éxito empresarial de la mitocondria, radica en un conjunto de asociaciones entre diversos sectores; además de que por sí sola no podría mantener su estatus productivo, también requiere de una gran coordinación con el núcleo y citosol. En los últimos años se han descubierto diversas enfermedades a causa de anomalías mitocondriales. El Diagnóstico temprano y nuevos blancos moleculares para tratamientos específicos, son los objetivos de la investigación de los procesos que ocurren en la mitocondria. Día con día se desarrollan nuevas técnicas moleculares que ayudan a comprender esta compañía, las proyecciones a futuro son el buen funcionamiento de la empresa donde los recursos sean aprovechados en su máxima capacidad sin generar pérdidas que lleven al colapso mitocondrial.
![]()
Villavicencio-Queijeiro, A. (2012). La mitocondria como fábrica de cofactores: biosíntesis de grupo hemo, centros Fe-S y nucleótidos de flavina (FMN/FAD). TIP-Revista especializada en ciencias químico-biológicas, 15(2):116-132.
http://www.scielo.org.mx/scielo.php?script=sci_abstract&pid=S1405-888X2012000200005&lng=pt&nrm=iso
Tuena de Gómez-Puyou, M. y García-Trejo, J.J. (2015). La bioenergética, las mitocondrias y la fosforilación oxidativa. Revista digital universitaria UNAM, 16(1):1-15.
http://www.revista.unam.mx/vol.16/num1/art05/
Boticario-Boticario, C. y Cascales-Angosto, M. (2012). Digestión y metabolismo energético de los nutrientes. UNED. Centro de Plasencia. 383 p.
https://www2.uned.es/ca-plasencia/DocumentosPDF/libros/Digestion.pdf
M.C. Luis Alberto Sánchez Briones, es estudiante del Programa Institucional de Doctorado en Ciencias Biológicas en la Opción Biología Experimental, adscrito al Instituto de Investigaciones Químico Biológicas de la Universidad Michoacana de San Nicolás de Hidalgo, donde actualmente realiza su tesis en el laboratorio de Biotecnología Microbiana acerca del funcionamiento de la mitocondria en la levadura Saccharomyces cerevisiae. Es de su interés contribuir a la generación y difusión del conocimiento, a la vez que considera que es importante dar a conocer a la sociedad el trabajo que se realiza en los centros de investigación científica.
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
D.B. Jesús Campos García, Profesor-Investigador Titular del Laboratorio de Biotecnología Microbiana del Instituto de Investigaciones Químico Biológicas de la Universidad Michoacana de San Nicolás de Hidalgo (IIQB-UMSNH). Es miembro de la Academia Mexicana de Ciencias A.C. (AMC) y del Sistema Nacional de Investigadores (nivel II). Premio Nacional de Investigación en Ciencias Naturales-2008 por la AMC, Premio Estatal de Investigación Científica y Humanística 2009 (Gob. Edo. Michoacán), Inventor de la primera Patente de la UMSNH (2009), actualmente posee 4 títulos de patentes. Su trabajo de investigación versa sobre los mecanismos de interacción de Pseudomonas aeruginosa en el ambiente: mecanismos de degradación, biocombustibles, interacción huésped-patógeno y metabolitos con potencial biotecnológico.
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
