
Imagen de <a href=”https://pixabay.com/es/users/alexas_fotos-686414
El cáncer es una enfermedad considerada dentro de las principales causas de muerte y un obstáculo importante para el aumento de la esperanza de vida en todos los países del mundo. Según estimaciones de la Organización Mundial de la Salud (OMS), en 2019, el cáncer era la primera o segunda causa de muerte antes de los 70 años, en 112 de 183 países, y ocupaba el tercer o cuarto lugar en otros 23 países.
En términos generales, el cáncer surge cuando un grupo de células comienza a proliferar de manera descontrolada y descoordinada con los tejidos normales adyacentes, y persiste de la misma manera excesiva después del cese de los estímulos que provocaron su cambio.
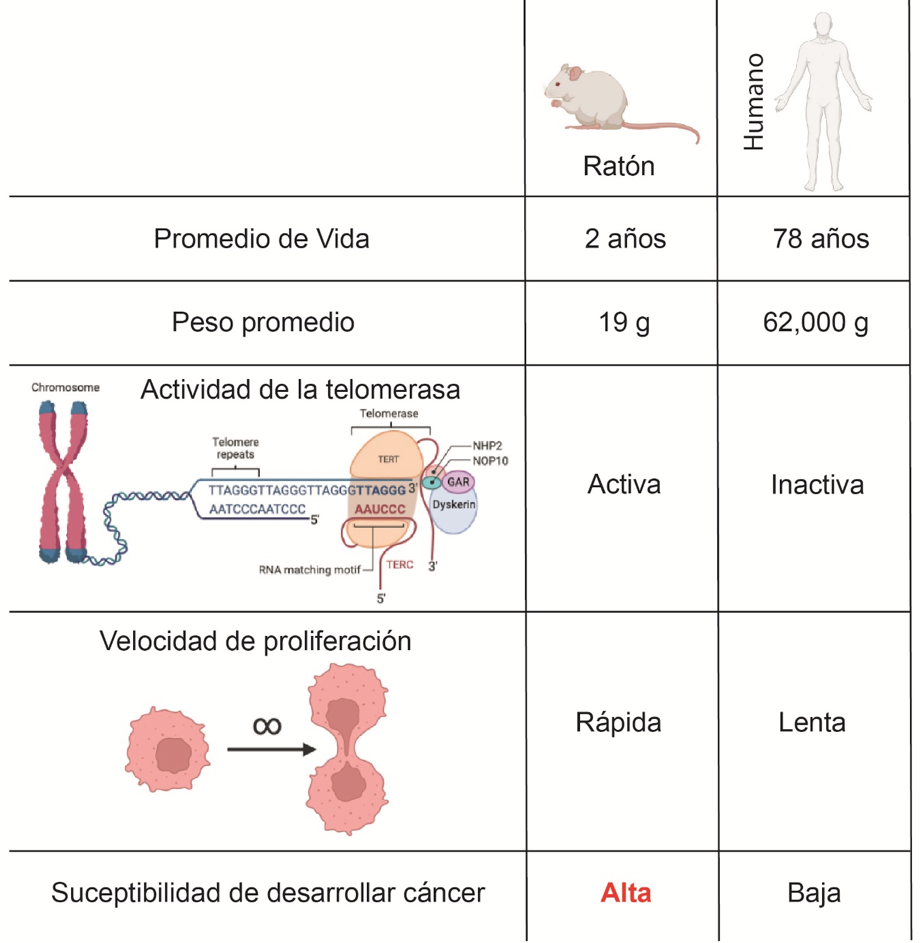
Los mamíferos han desarrollado diversos mecanismos que limitan el desarrollo del cáncer, pero no todas las especies tienen el mismo nivel de protección. Por ejemplo, entre el 50 % y el 90 % de los ratones viejos mueren de cáncer, mientras que, en los humanos, esta cifra ronda únicamente el 23 %. Además, cada especie requiere un número diferente de mutaciones para la transformación maligna. En este sentido, los fibroblastos de ratón requieren dos «hits»: la inactivación de la proteína TP53 o RB1 y una mutación activadora de HRAS para transformarse en cáncer, mientras que los fibroblastos humanos requieren cinco «hits» (inactivación de las proteínas TP53, RB1 y PP2A y activación constitutiva de la telomerasa y HRAS). En general, los animales grandes y longevos son más resistentes al cáncer.
 Comparación de ratones y humanos en su susceptibilidad al cáncer. Elaboración propia.
Comparación de ratones y humanos en su susceptibilidad al cáncer. Elaboración propia.
¿Por qué el tamaño y la longevidad influyen en la resistencia al cáncer de los mamíferos?
Una explicación sencilla es que los animales más grandes tienen más células somáticas con potencial para acumular mutaciones, por lo que, estadísticamente, su riesgo de desarrollar cáncer es mayor. Para contrarrestar este riesgo, las especies de mayor tamaño deben desarrollar mecanismos supresores de tumores más eficaces. Así pues, los mamíferos longevos y de gran tamaño, presentan estrategias anticancerígenas novedosas y más sofisticadas. Un análisis demostró que la actividad de la telomerasa, una ribonucleoproteína (un compuesto que combina ARN y proteínas) cuya función es replicar las secuencias repetitivas de los extremos de los cromosomas conocidas como telómeros, mostraba una correlación negativa muy fuerte con la masa corporal.
De hecho, se ha mencionado que todos los mamíferos de más de diez kilogramos presentan represión de la telomerasa en la mayoría de los tejidos somáticos. De esta manera, en la mayoría de las células somáticas humanas, la telomerasa está silenciada y, por lo tanto, a medida que las células se replican, sus telómeros se acortan, lo que finalmente conduce a la senescencia replicativa cuando las células con telómeros críticamente cortos entran en detención permanente del ciclo celular. La senescencia replicativa es un importante mecanismo supresor de tumores que limita la proliferación celular. En contraste, las células de ratón, donde la telomerasa está activa, no presentan este mecanismo y, por tanto, están un paso más cerca de la transformación maligna que las células humanas.
Otro factor que influye en el riesgo de cáncer es la presión evolutiva. Un animal que desarrollara un cáncer antes de su edad reproductiva no dejaría descendencia, por lo tanto, los animales desarrollaron mecanismos eficientes para retrasar la aparición de tumores hasta la edad post-reproductiva. Así, el cáncer se vuelve común en animales viejos que ya no están sujetos a la selección natural. Como consecuencia, se espera que los animales longevos tengan defensas anticancerígenas más eficientes para mantenerse libres de cáncer por más tiempo. A modo de ejemplo, se planteó la hipótesis de que los mecanismos que retrasan la proliferación celular también actúan para restringir el crecimiento maligno. Se ha informado que la capacidad de los fibroblastos para transformarse en células cancerosas y formar colonias en agar blando tras la inactivación de la proteína TP53 o RB1 y la expresión exógena de HRASG12V, se correlacionaba negativamente con la esperanza de vida de los animales que donaban dichas células. En otras palabras, cuanto mayor sea la esperanza de vida del mamífero, menor será la probabilidad de que sus células se transformen en cáncer. Junto a esto, las células de mamífero de vida corta generaron tumores cuando se inyectaron en ratones inmunodeficientes, mientras que las células de mamíferos de vida larga no lo hicieron hasta que se añadieron más mutaciones.
En resumen, tanto la masa corporal como la esperanza de vida determinan la evolución de los mecanismos supresores de tumores. El tamaño corporal determina la actividad de la telomerasa, mientras que la esperanza de vida determina otros mecanismos supresores de tumores.
 Comparación de ratones y humanos en su susceptibilidad al cáncer. Elaboración propia.
Comparación de ratones y humanos en su susceptibilidad al cáncer. Elaboración propia.
¿Qué otros mecanismos supresores de tumores se han observado en los mamíferos?
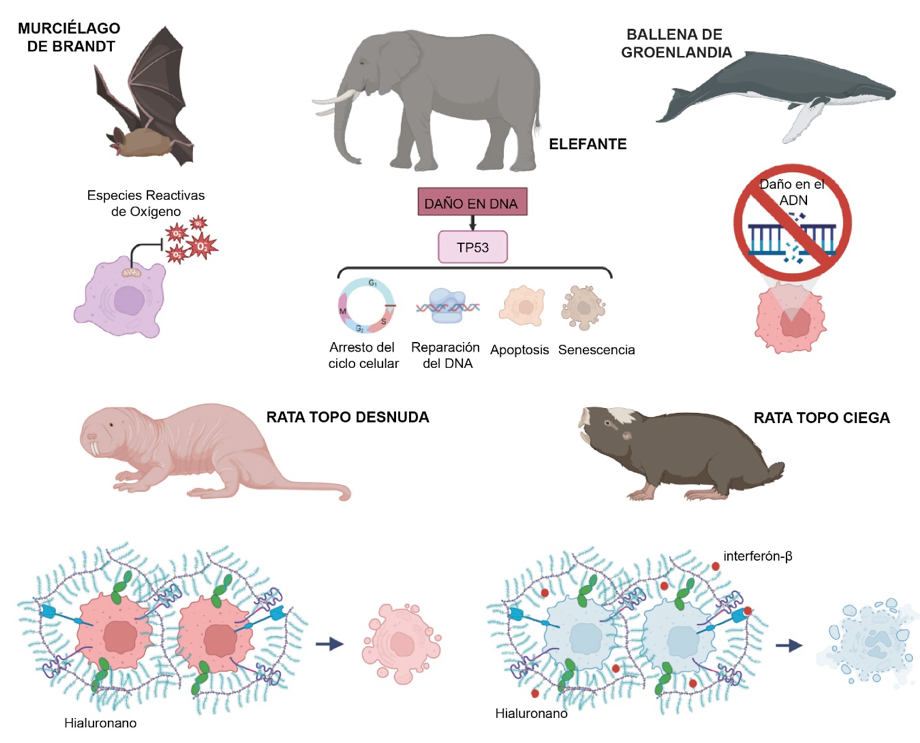
Cabe señalar que algunos de estos mecanismos anticancerígenos que los mamíferos han adquirido de forma natural a través de la evolución, son comunes a varias especies resistentes al cáncer, mientras que otros solo han evolucionado en algunos grupos individuales. Los murciélagos representan una gran proporción de las especies de mamíferos, los cuales han sido objeto de numerosos estudios, por ello, resulta sorprendente que solo se han descrito unos pocos casos de tumores en murciélagos. Todos los murciélagos son longevos en relación con su masa corporal (la esperanza de vida oscila entre siete y 42 años), pero, curiosamente, los más longevos (el murciélago de Brandt, con una esperanza de vida de 42 años) también se encuentran entre los más pequeños.
Estudios recientes sugieren un papel crítico de la función mitocondrial en la fisiología de los murciélagos, la cual evolucionó para contrarrestar el estrés oxidativo resultante de actividades metabólicamente costosas, en particular el vuelo. Además, se ha demostrado que las células de los murciélagos longevos proliferan más lentamente al tener una menor señalización de algunos factores de crecimiento, a la vez que pueden reparar los daños en el ADN y prevenir el estrés oxidativo con mayor eficacia.
Por su parte, los elefantes son mamíferos longevos y de crecimiento lento que sobreviven hasta 70 años en libertad. Es de destacar que sus células tienen una mayor respuesta al daño del ADN dependiente de la proteína TP53, lo que conduce a una mayor sensibilidad al estrés genotóxico. Se han identificado 19 pseudogenes (secuencias similares al gen, pero que no codifican una proteína) del gen TP53 en el genoma del elefante y algunos de ellos se transcriben. Aparentemente, estos transcritos protegen a la proteína TP53 de la degradación, por lo que permanece activa durante más tiempo. Esto puede actuar como mecanismo anticancerígeno al eliminar de forma más agresiva las células dañadas antes de que se conviertan en precancerosas.
Por otro lado, las ballenas son criaturas muy grandes que han desarrollado nuevas adaptaciones contra el cáncer. Estudios comparativos en ballenas de Groenlandia —las más longevas—, han identificado un mayor número de copias o una mayor expresión de varios genes relacionados con el cáncer y con el envejecimiento, principalmente, algunos asociados con la reparación del ADN. Así, se presume que las células de ballena acumulan menos mutaciones cancerosas y no alcanzan un estadio preneoplásico.
La rata topo desnuda —originaria de África Oriental— es un roedor del tamaño de un ratón que vive en túneles subterráneos que él mismo construye; es extremadamente longevo, con una esperanza de vida máxima de 32 años y es muy resistente al cáncer. Múltiples mecanismos contribuyen a la notable resistencia a esta enfermedad, entre ellos, un fenómeno denominado inhibición temprana por contacto. La inhibición por contacto es una propiedad que hace que las células normales dejen de proliferar cuando entran en estrecho contacto unas con otras. En cambio, las células cancerosas pierden la inhibición por contacto y siguen proliferando. Las células de la rata topo desnuda son más sensibles a la inhibición por contacto que las células normales de otras especies y detienen la proliferación celular en fases más tempranas.
Se ha demostrado que la señal extracelular que conduce a la inhibición temprana por contacto es un hialuronano (polisacárido) único de alta masa molecular secretado por células de rata topo desnuda. Estas moléculas de hialuronano más largas tienen propiedades antiproliferativas, antiinflamatorias y antimetastásicas. En contraste, las moléculas más cortas, como las secretadas por células de ratón y las humanas, se asocian a inflamación, proliferación más rápida y metástasis (migración de células de un tejido a otro). Además, las células de rata topo desnuda tienen una capacidad única para detectar la pérdida de un supresor tumoral como TP53, RB1 o p19ARF y someterse a la muerte celular para evitar la transformación maligna.
Por último, las ratas topo ciegas son roedores que habitan túneles subterráneos en bosques y en valles montañosos de Oriente Medio. Al igual que la rata topo desnuda, la rata topo ciega es longeva, con una esperanza de vida máxima de 21 años y también es resistente al cáncer. En respuesta a la hiperproliferación, las células de la rata topo ciega segregan una proteína llamada interferón-β, la cual desencadena una muerte celular concertada que sirve de manera eficaz en la eliminación de las células premalignas. Además, de forma similar a la rata topo desnuda, las células de la rata topo ciega segregan abundante hialuronano de alta masa molecular y obtienen sus beneficios. Sin embargo, a diferencia de las células de rata topo desnuda, las células de rata topo ciega no muestran una inhibición temprana por contacto.
Los mecanismos para evitar el cáncer en mamíferos dependen de la especie
Los mamíferos han desarrollado varios mecanismos para evitar el cáncer a través de la evolución; sin embargo, dependiendo de la especie, existen diferencias en el nivel de protección. Algunos de estos mecanismos están relacionados con el tamaño y la longevidad del organismo, de modo que los animales grandes y longevos tienden a ser más resistentes al cáncer. El estudio de los mamíferos longevos es un área de gran interés porque aportará pistas para mejorar la calidad de vida y para reducir la incidencia del cáncer.

Francisco Alejandro Lagunas-Rangel. Departamento de Ciencias Quirúrgicas, Uppsala University, Uppsala, Suecia.
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Erten E. Y. y Kokko H. (2019). Formas diversas de pensar sobre el cáncer: ¿Qué podemos aprender acerca del cáncer estudiándolo a través del árbol de la vida? Métode Revista de Difusión de La Investigación, 10. https://doi.org/10.7203/metode.10.14593. https://metode.es/revistas-metode/monograficos/formes-diverses-de-pensar-sobre-el-cancer.html
Lagunas-Rangel F. A. (2021). Deciphering the whale’s secrets to have a long life. Experimental Gerontology, 151, 111425. https://doi.org/10.1016/j.exger.2021.111425. https://www.sciencedirect.com/science/article/pii/S0531556521002072
Tume-Farfán L. F. (2014). Las ratas topo y sus mecanismos de resistencia al cáncer y envejecimiento. The Biologist (Lima), 12(1), 117-132. https://dialnet.unirioja.es/servlet/articulo?codigo=4755792
