Las bacterias son organismos unicelulares procariotas que solo se observan por medio de un microscopio óptico debido a su pequeño tamaño (oscila entre 0.1 y 1 micrómetro). Estas se encuentran ampliamente distribuidas en una gran diversidad de hábitats y nichos ecológicos. En los animales, incluyendo el humano, son habitantes comunes, muchas de ellas sin provocar daños y aportando beneficios. No obstante, algunas pueden ser patógenas, por lo que representan un problema de salud pública, de ahí que sean objeto de estudio para entender sus mecanismos de patogenicidad y el desarrollo de estrategias de control. La Organización Mundial de la Salud publicó en marzo de 2021 la lista de bacterias prioritarias, debido al riesgo que representan para la población, particularmente por su resistencia a diversos grupos de antibióticos.
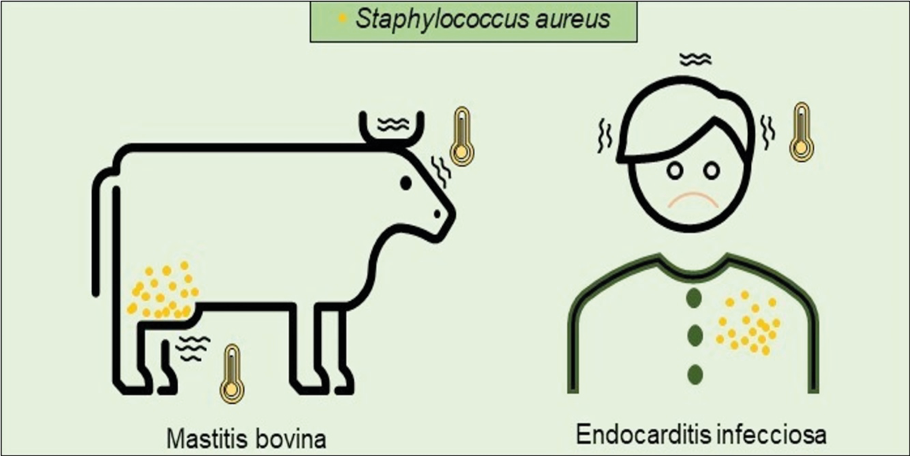
En esta lista se encuentra Staphylococcus aureus, bacteria asociada a diversas enfermedades en humanos (ej. endocarditis, osteomielitis, síndrome de choque tóxico) y en animales (ej. mastitis). S. aureus fue descubierta por Alexander Ogston en 1880, quien le asignó el nombre de Staphylococcus, del griego Staphy que significa ‘racimo de uvas’. Posteriormente, Anton J. Rosenbach, en 1884, la nombró Staphylococcus aureus, del latín aurum, por el color oro que posee.
El éxito de este microorganismo patógeno se debe no solo a su resistencia a los antibióticos, sino también a que posee una serie de factores de virulencia que, para fines didácticos, llamaremos «tácticas» de adhesión, invasión, evasión, resistencia, colonización y diseminación. Dichos factores le permiten adherirse a las células de su hospedero, invadirlas con mayor rapidez, evadir sus múltiples respuestas de defensa, establecerse persistentemente en el interior de las células y diseminarse. A continuación, se describen brevemente las «tácticas» referidas y se enfatiza la necesidad de estudiarlas como posibles blancos terapéuticos antivirulencia diferentes a los de los antibióticos.
 Staphylococcus aureus vista al microscopio electrónico de barrido, unida a un material polimérico (5000 x). Micrografía tomada por la Dra. Yvain de los Ángeles Salinas Delgado, Universidad de La Ciénega del Estado de Michoacán de Ocampo.
Staphylococcus aureus vista al microscopio electrónico de barrido, unida a un material polimérico (5000 x). Micrografía tomada por la Dra. Yvain de los Ángeles Salinas Delgado, Universidad de La Ciénega del Estado de Michoacán de Ocampo.
«Tácticas» ofensivas y defensivas de S. aureus
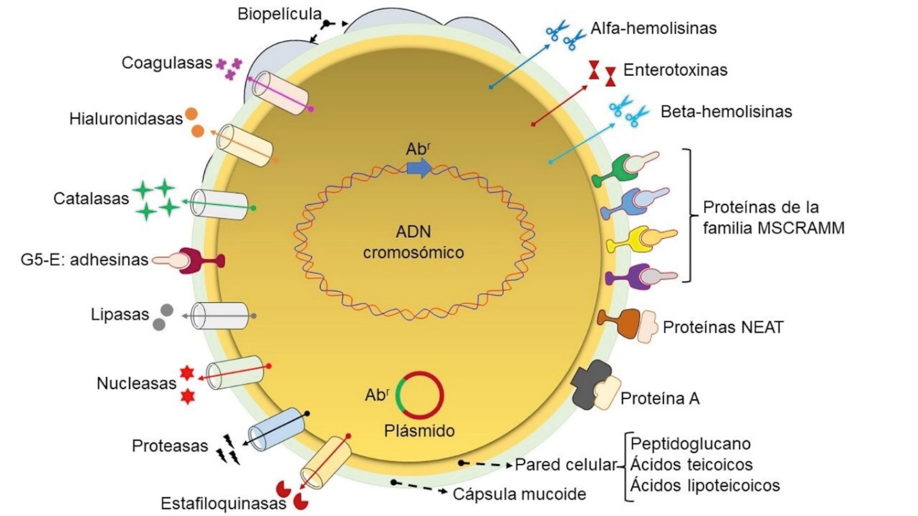
La pared celular de S. aureus está constituida por un componente complejo llamado peptidoglucano, principalmente mureína, formado de N-acetilglucosamina y de ácido N-acetilmurámico, además de otros azúcares conocidos como ácidos teicoicos (polímeros de glicerol o ribitol) y lipoteicoicos (moléculas anfifílicas ancladas a la membrana citoplasmática). Estas moléculas son componentes que inducen la adhesión bacteriana a la superficie del hospedero, promueven su resistencia y estimulan su habilidad para «moverse» hacia el alimento o alejarse de sustancias dañinas. Asimismo, poseen una cápsula mucoide, formada por azúcares que también facilita su adhesión al hospedero y le confiere resistencia frente a células de defensa, como los neutrófilos polimorfonucleares. La cápsula de S. aureus fue descrita por primera vez en 1931 por Gilbert Isabelle, quien aisló al microorganismo de la sangre del corazón de un paciente con endocarditis (inflamación de la membrana que cubre al corazón).
Es común que las cepas de S. aureus produzcan una biopelícula, también conocida como «biofilm», constituida por una comunidad de células bacterianas embebidas en una matriz compuesta de azúcares, proteínas y ácidos nucleicos, y adherida a una superficie inerte o tejido vivo. Esta estructura contribuye a la persistencia de la bacteria, aumenta su resistencia a los antibióticos y permite que se disemine con mayor facilidad. Este factor de protección y propagación de la bacteria fue observado por primera vez en la placa dental por Anton Van Leeuwenhoek en 1683.
Algunas cepas de S. aureus también producen enzimas extracelulares (exoenzimas) y exotoxinas que le permiten adherirse a las células del hospedero, invadir los tejidos, escapar de los sistemas de defensa y diseminarse hacia otros tejidos. Las enzimas extracelulares incluyen proteínas como la coagulasa, que facilita el desarrollo de abscesos evitando la eliminación de la bacteria; catalasa, que degrada el peróxido de hidrógeno, «táctica» que usa para evitar su eliminación del hospedero; hialuronidasa, que degrada al ácido hialurónico de los tejidos, promoviendo la diseminación de la bacteria; además, produce lipasas, nucleasas, proteasas y estafiloquinasas, enzimas que en conjunto destruyen los tejidos del hospedero, lo cual facilita la penetración y diseminación bacteriana.
Asimismo, diversas cepas de S. aureus sintetizan exotoxinas, divididas en tres grandes grupos: citotoxinas, superantígenos y enzimas citotóxicas. Las citotoxinas incluyen moléculas como la alfa y la gamma-hemolisinas formadoras de poros, entre otras. Estos factores tienen la capacidad de destruir eritrocitos, plaquetas, células epiteliales y del sistema inmune como neutrófilos, monocitos y macrófagos, además de causar inflamación de los tejidos. Los superantígenos de células T representan la familia más grande de exotoxinas producidas por S. aureus, las cuales, además de ser sumamente tóxicas para los mamíferos, también tienen la capacidad de favorecer la evasión del sistema inmune. Las enterotoxinas estafilocócicas son responsables de cuadros de enterocolitis en humanos. Por su parte, las enzimas citotóxicas incluyen proteínas como la beta-hemolisina, toxina exfoliativa, toxina del síndrome del choque tóxico, entre otras. Dichas moléculas también promueven la evasión del sistema inmune, la producción de la biopelícula y la exfoliación epidérmica, entre otras.
S. aureus posee proteínas que «decoran» su superficie celular, las cuales son cruciales para el éxito de la bacteria como comensal (obtiene beneficios de su hospedero, pero sin lastimarlo) o como patógeno. Estas moléculas se clasifican en cuatro grandes familias:
- Componentes microbianos de superficie reconocidos como MSCRAMM (por sus siglas en inglés), es el grupo más importante, ya que tienen participación en el proceso de patogénesis al unirse a proteínas de la superficie de las células del hospedero como fibrinógeno, fibronectina, colágeno, elastina, entre otras, facilitando su internalización y la evasión del sistema inmune.
- Otro grupo importante recibe el nombre de NEAT (por sus siglas en inglés), proteínas que capturan al grupo químico «hemo» de la hemoglobina y auxilian a la bacteria a sobrevivir dentro del hospedero.
- La proteína A, factor multifuncional que bloquea la acción de anticuerpos del hospedero (IgG), con lo que previene la eliminación de la bacteria.
- La familia de proteínas G5-E, asociada a la adhesión a las células del hospedero y a la formación de la biopelícula, lo que beneficia la invasión, la permanencia y la defensa de S. aureus. Adicionalmente, existen otras proteínas no estudiadas que participan en la virulencia de S. aureus.
Como se observa, la resistencia a antibióticos no es la única «arma» disponible en el arsenal de S. aureus, ya que contiene numerosas «tácticas», tanto ofensivas como defensivas, que representan la base de su patogenicidad, además de su habilidad para evadir el sistema inmune del hospedero. Lo anterior muestra la necesidad de realizar estudios más profundos sobre el funcionamiento y la regulación de dichas «tácticas», así como su posible uso como blancos moleculares en el diseño de terapias no antibióticas dirigidas a la reducción del creciente impacto de S. aureus en la salud humana y animal.
En este sentido, existen interesantes avances en los que destaca el estudio de potenciales terapias antivirulencia, basadas en el uso de moléculas que interfieren con las toxinas, polisacáridos capsulares, enzimas o proteínas de superficie bacteriana, síntesis de la biopelícula y/o con las vías que median la virulencia (ej. anticuerpos neutralizantes antitoxina, derivados de β-ciclodextrinas, oroxilina A, oroxina A, oroxina B, hidrato de morina, inhibidor ADAM10, sulfasalazina, péptidos animicrobianos, solonamida A, solonamida B, proteínas diversas, por mencionar algunos). Aunque en la actualidad no existen agentes antivirulencia aprobados para uso clínico, cada día se acumula mayor evidencia que muestra las ventajas de utilizar tales agentes terapéuticos, en particular sobre S. aureus resistente a antibióticos.

S. aureus y su gran artesanal de peligro
S. aureus es un patógeno «formidable» capaz de ocasionar múltiples enfermedades gracias al «arsenal» de «tácticas» moleculares que posee y que de alguna manera manipulan las respuestas del sistema inmune del hospedero para su beneficio, entre otras acciones de adhesión, invasión, evasión, resistencia, colonización y diseminación. Pareciera ser que la naturaleza dotó a esta bacteria de una serie de «dispositivos» que utiliza eficazmente para infectar tejidos, lo que la convierte en un enemigo microscópico peligroso. Por lo anterior, es necesario continuar estudiando dichos factores de virulencia y poner mayor atención en su uso como posibles blancos de agentes terapéuticos antivirulencia.
Para Saber Más:
Camussone C. M. y Calvinho L. F. (2013). Factores de virulencia de Staphylococcus aureus asociados con infecciones mamarias en bovinos: Relevancia y rol como agentes inmunógenos. Revista Argentina de Microbiología, 45, 119-130. https://doi.org/10.1016/S0325-7541(13)70011-7
Foster, T. J. (2019). The MSCRAMM family of cell-wall-anchored surface proteins of Gram-Positive cocci. Trends in Microbiology, 27, 927-941. https://doi.org/10.1016/j.tim.2019.06.007
Orenstein, A. (2006). The discovery and naming of Staphylococcus aureus. http://www.antimicrobe.org/h04c.files/history/S-aureus.pdf
Organización Mundial de la Salud. (2021). Patógenos multirresistentes que son prioritarios para la OMS. https://www.paho.org/es/noticias/4-3-2021-patogenos-multirresistentes-que-son-prioritarios-para-oms
Pedro Damián Loeza-Lara. Profesor e Investigador de la Licenciatura en Genómica Alimentaria y de la Maestría en Biociencias en la Universidad de La Ciénega del Estado de Michoacán de Ocampo (UCEMICH).
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Joel Edmundo López-Meza. Profesor e Investigador del Centro Multidisciplinario de Estudios en Biotecnología (CMEB), Facultad de Medicina Veterinaria y Zootecnia, Universidad Michoacana de San Nicolás de Hidalgo.
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
