La optogenética es una técnica que ha transformado la neurociencia, ya que permite el control específico de la actividad neuronal mediante la luz, con la que se han superado limitaciones de métodos anteriores, ofreciendo una precisión en el estudio de las funciones cerebrales complejas. La base de la optogenética radica en el uso de proteínas sensibles a la luz —como la canalrodopsina-2— que, al exponer a esta, desencadenan respuestas neuronales precisas, lo que permite encender o apagar neuronas a voluntad. Esta capacidad ha permitido realizar experimentos en modelos animales que revelan cómo ciertas áreas del cerebro controlan comportamientos específicos, como la ingesta de alimentos. La optogenética abre nuevas posibilidades terapéuticas para tratar enfermedades neurológicas. Aunque se ha avanzado mucho, su potencial clínico aún está en desarrollo, ofreciendo un futuro prometedor en la medicina.
Palabras clave: Aprendizaje y memoria, cerebro, comportamiento animal, optogenética.
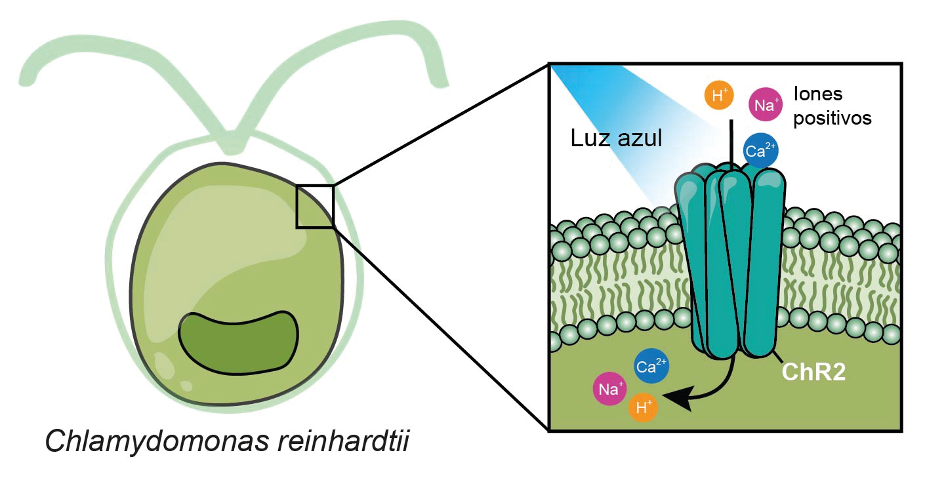
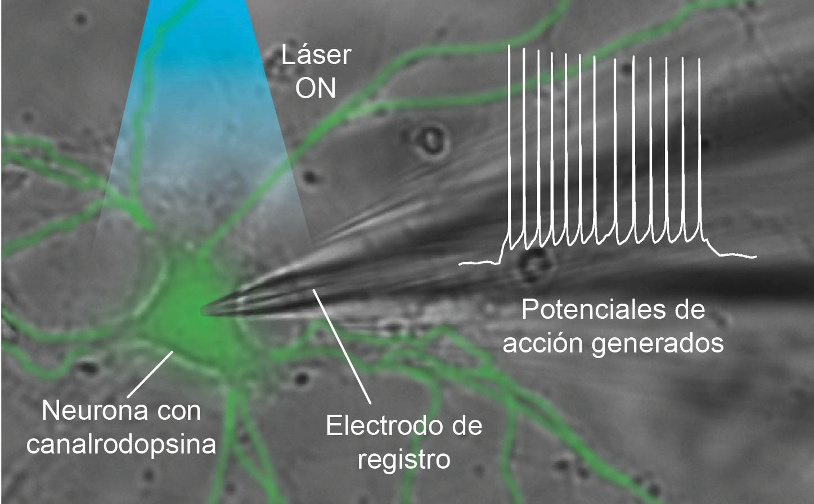
Gabriel Herrera-López El cerebro es un sistema tan complejo que se han tenido que desarrollar diferentes estrategias para estudiarlo, utilizando modelos animales simples como el gusano Caenorhabditis elegans o mamíferos pequeños como rata o ratón con los que se pueden usar electrodos de estimulación eléctrica, hasta técnicas de imagen que permiten identificar áreas del cerebro que se activan al realizar alguna acción específica, una técnica no invasiva llamada resonancia magnética funcional. Sin embargo, todas las técnicas tienen ventajas y desventajas. Una de las principales limitaciones del estudio de las funciones de las partes del cerebro es su especificidad. Desde algunos años atrás, sabemos, por ejemplo, que el hipocampo es un área cerebral que controla procesos de aprendizaje y memoria a corto plazo, pero aun el hipocampo, más pequeño que el cerebro, es bastante complejo, ya que cuenta con comunicación entre las células que lo componen y con otras estructuras del cerebro, coordinándose armónicamente para controlar los procesos que les adjudicamos. Entonces, ¿cómo podemos saber que un área cerebral en verdad se encarga de manipular una tarea en específico? Y, más allá, ¿será que cada neurona de un área en particular participa de la misma manera en el control de las tareas del cerebro, como aprender o decidir qué comer? Las respuestas a estas y otras preguntas se habían escapado de las manos de los neurocientíficos debido a la poca especificidad de las técnicas existentes, pero en los últimos años se han desarrollado metodologías que permiten estudiar el cerebro desde otra perspectiva. Pensemos en la posibilidad de ponerles a las células del cerebro un interruptor de encendido que podamos manipular a nuestro antojo y, además, que lo podamos expresar de forma específica en un solo tipo celular según lo que deseemos estudiar. Hasta aquí todo suena como una historia de ciencia ficción, pero la realidad es más impresionante. La posibilidad de activar neuronas a demanda existe y se ha logrado gracias a una técnica llamada optogenética que usa un vector para acarrear proteínas sensibles a la luz y expresarlas en neuronas para manipular su actividad. La receta para la optogenética requiere cuatro ingredientes: neuronas que queremos estudiar, interruptor de encendido, una manera de poner el interruptor y luz para activar el interruptor. El desarrollo de la optogenética comenzó, por así decirlo, lejos de las neurociencias, en un organismo carente de cerebro: un alga microscópica unicelular llamada Chlamydomonas reinhardtii. Estas algas se mueven según lo hace la luz del sol, casi como si fueran capaces de ver la luz, aunque no tienen ojos. Esto es posible gracias a que expresan una proteína similar a la de nuestros ojos que nos permite ver, un grupo de moléculas conocidas como opsinas, las cuales responden a diferentes longitudes de onda de la luz. En el caso de esta alga (C. reinhardtii), esta proteína sensible a la luz recibe el nombre de canalrodopsina-2 (o solo canalrodopsina), referida en inglés como channelrodopsin-2 (ChR2) y se convirtió en un muy buen candidato para activar neuronas a voluntad, tanto así, que se pudo usar por primera vez en el año 2005 para activar neuronas usando luz, esto gracias al equipo de investigación de Karl Deisseroth en la Universidad de Stanford, en California. Hasta aquí, tal vez te estés preguntando por qué no usamos nuestras propias opsinas como interruptor y en su lugar tuvimos que encontrar la canalrodopsina en otro organismo. La razón es que nuestras opsinas y las de las algas funcionan de manera muy diferente. Aunque ambas responden a la luz, las de nuestros ojos son lentas y dependen de la activación de segundos mensajeros, algo así como una cadena de relevos dentro de la célula, mientras que la opsina de las algas es mucho más rápida y solo requiere abrirse para permitir el movimiento de iones hacia el interior de la célula para generar una corriente eléctrica que active las neuronas. Esta corriente se logra gracias al paso de iones positivos como H+, Na+ y Ca2+, átomos cargados que, al entrar a la neurona, cambian el potencial eléctrico y permiten que la neurona «dispare» potenciales de acción, choques eléctricos que facilitan la liberación de neurotransmisores, mensajeros químicos con la capacidad de enviar un mensaje específico a la siguiente neurona conectada. Aunque la canalrodopsina fue la primera en usarse, actualmente existen muchas otras proteínas que se pueden emplear para estudios del cerebro mediante optogenética, como la halorodopsina, que se activa con luz amarilla y permite el paso de iones cargados negativamente a la célula (particularmente Cl-), lo que da como resultado una reducción de la actividad cuando se expresa en las neuronas. Tomar la proteína del alga y ponerla en las neuronas es un proceso relativamente sencillo, ya que podemos aprovechar un mecanismo que ya existe en la naturaleza para introducir material genético a las células: los virus. Cada proteína está codificada por un gen, un fragmento de ADN en el núcleo de las células que podemos pensar como las instrucciones para hacer una proteína. Si conocemos la secuencia de este gen, podemos sintetizarlo y dárselo a las células que deseemos para que lo expresen. Este fragmento de ADN se entrega a las neuronas gracias a un proceso común a todos los virus. Primero, generamos un virus que contenga el fragmento de ADN que codifica para la canalrodopsina, luego ese virus se inyecta en el cerebro de ratones o en neuronas en cultivo, permitimos que el virus infecte las neuronas y que les inyecte el material genético; al hacer esto, las neuronas cuentan con la receta para hacer la canalrodopsina. Para la especificidad, y permitir que la canalrodopsina solo se exprese en un tipo particular de neuronas, el vector viral se combina con el uso de animales transgénicos, pero dejemos eso para otra ocasión. Tal vez te imagines que esta maniobra podría ocasionar una catástrofe mundial como la de la pandemia por COVID-19, pero no hay de qué alarmarse, ya que dentro de los virus más usados como vectores tenemos los adenovirus asociados que, irónicamente, no han sido asociados con ninguna enfermedad en los humanos. Si bien la optogenética se usó por primera vez en experimentos in vitro, sin duda alguna son más vistosos los experimentos diseñados para estudiar el comportamiento animal, aplicación gracias a la cual llegué a conocer la técnica. Para este tipo de experimentos, se inyecta el virus directamente en el cerebro de ratones para que expresen la canalrodopsina y también se les implanta una fibra óptica que dirige un láser a la zona donde están las células a las que se les incluyó la canalrodopsina para activarlas o inactivarlas con la presencia de la luz. Esto resulta, según una buena amiga, en ratoncitos con sombrero. La siguiente imagen ilustra un experimento en el que la canalarodopsina se expresó en neuronas del hipotálamo, un área cerebral que, entre otras cosas, regula la ingesta de alimentos. Cuando la luz del láser está apagada, el ratoncito es indiferente a la presencia de alimento, pero cuando se enciende la luz, se activan las neuronas del hipotálamo, el ratón toma el alimento más cercano y comienza a comer. La conducta cesa al apagarse el láser. Este es solo uno de muchos ejemplos de experimentos que se han logrado utilizando esta técnica, ya que también se ha propuesto para el tratamiento de trastornos como la enfermedad de Alzheimer, los infartos cerebrales y el manejo del dolor, entre otros. Decía un amigo del laboratorio donde hice mi doctorado: «Sería maravilloso poder apagar el dolor a voluntad, con solo oprimir un interruptor». Esta técnica ha permitido desentrañar varios de los misterios del funcionamiento del cerebro en condiciones fisiológicas normales y durante procesos patológicos, permitiendo su uso rutinario en varios laboratorios del mundo. Su especificidad y selectividad, la hacen un candidato con aplicaciones clínicas, aunque para eso, aún falta camino por recorrer.
Boyden E.S., Zhang F., Bamberg E., Nagel G. y Deisseroth K. (2005). Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience, 8(9), 1263-1268. https://doi.org/10.1038/nn1525 Krawczyk M., Millan J. y Boccia M. (2017). Optogenética: Un haz de luz para conocer las funciones cerebrales. Ciencias e Investigación, 67(3), 29-34. https://ri.conicet.gov.ar/bitstream/handle/11336/48314/CONICET_Digital_Nro.a6795908-9577-412f-a5af-4816d7455e8e_A.pdf?isAllowed=y&sequence=2 Pérez-Túlich L. (2019). Desarrollo de ratones knockout. Blog de Bioingeniería. https://www1.utec.edu.pe/blog-de-carreras/bioingenieria/desarrollo-de-ratones-knockout Suleng K. (2018). Optogenética, la gran revolución del estudio del cerebro. OpenMind. https://www.esi.academy/wp-content/uploads/1LP6-Optogene%CC%81tica-la-gran-revolucio%CC%81n-del-estudio-del-cerebro-OpenMind-copia-2.pdf Yuste R. (2019). Las nuevas neurotecnologías y su impacto en la ciencia, medicina y sociedad. Universidad de Zaragoza. Zaguán. Repositorio Documental de Documentos. https://doi.org/10.26754/uz.978-84-1340-038-9
Resumen

Investigador postdoctoral en Laboratory for Cellular Imaging and Energetics,
Biological and Environmental Sciences and Engineering Division (BESE),
King Abdullah University of Science and Technology (KAUST),
Thuwal, Kingdom of Saudi Arabia.
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.Develar los misterios del cerebro
En búsqueda de un interruptor. La ayuda de un alga
Instalando el interruptor en las neuronas o la genética de la optogenética
Aplicando la optogenética
La optogenética es una técnica poderosa
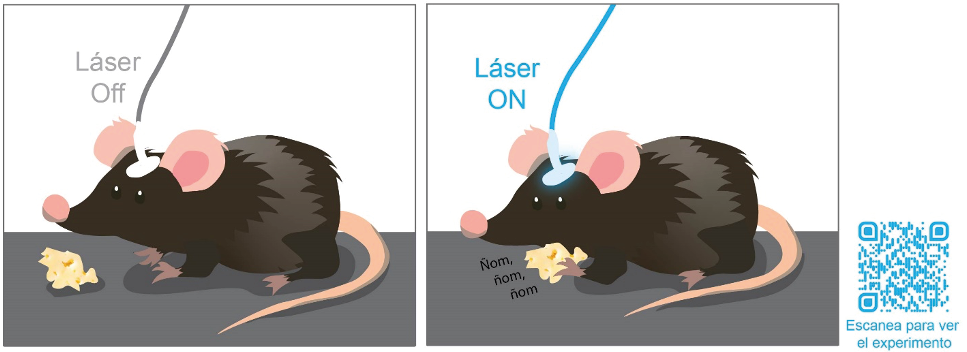
Experimento de optogenética. Ratón con fibra óptica implantada cerca del hipotálamo lateral. La activación de estas neuronas con luz, gracias a la presencia de canalrodopsina, ocasiona una estimulación de la conducta de ingesta y el ratón come. Puedes ver el video del experimento real, escaneando el código QR a la derecha del segundo panel. (Elaboración propia).
Optogenética: cuando las neuronas ven la luz
Año 14 / Número 79 / 2025
RECIBIDO: 11/11/2024; ACEPTADO: 30/11/2024; PUBLICADO: 14/02/2025

